È online il settimo contributo dedicato alla promozione dei risultati della ricerca dei nostri dottorandi.
Elena Genova, Corso di Dottorato in Scienze della Riproduzione e dello Sviluppo.
Biomarcatori e terapia di precisione nelle immunodeficienze primarie: uno studio in vitro basato sulle cellule staminali pluripotenti indotte.
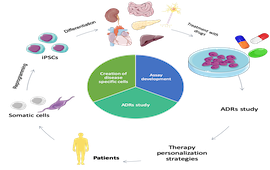
Nel 2006 Takahashi e Yamanaka hanno introdotto al mondo scientifico un nuovo tipo di cellule staminali, le così dette cellule staminali pluripotenti indotte o CSPi (premio Nobel per la medicina nel 2012). Queste cellule possono essere facilmente ottenute esponendo in vitro a stimoli di riprogrammazione, cellule somatiche, comprese le cellule mononucleate che possono essere isolate da pochi millilitri di sangue, evitando procedure invasive. I 4 fattori di riprogrammazione utilizzati ricreano uno stato simil-embrionale e la capacità di differenziare in cellule dei 3 foglietti germinali e in ogni tipo di cellula adulta al pari delle cellule staminali embrionali. Le CSPi, mantenendo il background genetico dell’individuo, rappresentano un ottimo strumento per modelli in vitro paziente-specifici. Da più di un decennio, i ricercatori utilizzano le CSPi per modellare malattie causate da difetti genetici, incluse le malattie rare per le quali lo sviluppo di nuove terapie può essere particolarmente difficile dato il numero limitato di pazienti (1 su 2000). Le CSPi sono una fonte preziosa di cellule e tessuti, rappresentativa di queste condizioni, presentando le alterazioni genomiche d’interesse e rendendo possibile lo svolgimento di esperimenti in vitro al fine di sviluppare terapie personalizzate innovative.
In questo contesto è stato messo a punto un modello in vitro di sindrome di Aicardi Goutières (AGS) e Atassia Telangiectasia (AT), due rare sindromi ereditarie caratterizzate da disordini immunitari con sintomi prevalentemente neurologici (https://www.agsamericas.org), utilizzando CSPi paziente-specifiche e investigando gli effetti citotossici di farmaci immunomodulatori potenzialmente efficaci. Le CSPi sono state ottenute riprogrammando cellule di un paziente affetto da AT e da 3 pazienti con forme diverse di AGS (AGS1, AGS2 e AGS7) e, come controllo, la linea BJ di fibroblasti umani. La citotossicità è stata analizzata per desametasone e mepacrina, farmaci impiegati rispettivamente nell’AT e AGS. I dati sono stati ottenuti anche per altri immunomodulatori (tioguanina, mercaptopurina, talidomide e lenalidomide). E’ stata analizzata l’espressione relativa dei geni coinvolti nelle pathway dei farmaci testati e confrontati con l’espressione di linee di controllo (figura 1). Le linee di controllo sono state scelte in base alla loro sensibilità in vitro agli effetti citotossici dei farmaci testati. L’espressione di HPRT1, gene importante nella pathway di attivazione delle tiopurine, è stata valutata come marcatore per gli effetti in vitro di questi farmaci risultando il 50% meno espressa nella linea BJ-CSPi rispetto alla linea sensibile CCRF-CEM. L’espressione di NR3C1, gene codificante per il recettore intracellulare per i glucocorticoidi è risultato il 97% meno espresso rispetto alla linea sensibile NALM6. Successivamente è stata analizzata l’espressione di MB21D1, gene codificante per un enzima cruciale nella pathway di rilevamento degli acidi nucleici citoplasmatici e nella conseguente produzione di interferone risultando circa il 50% in meno nelle BJ-CSPi rispetto alla linea sensibile monocitaria THP1. Per talidomide e lenalidomide è stato analizzato il gene cereblon (CRBN), principale target degli effetti farmacologici, risultando 350% più espresso nella linea BJ-CSPi rispetto alle THP1. ilmente ottenute esponendo in vitro a stimoli di riprogrammazione, cellule somatiche, comprese le cellule mononucleate che possono essere isolate da pochi millilitri di sangue, evitando procedure invasive. I 4 fattori di riprogrammazione utilizzati ricreano uno stato simil-embrionale e la capacità di differenziare in cellule dei 3 foglietti germinali e in ogni tipo di cellula adulta al pari delle cellule staminali embrionali. Le CSPi, mantenendo il background genetico dell’individuo, rappresentano un ottimo strumento per modelli in vitro paziente-specifici. Da più di un decennio, i ricercatori utilizzano le CSPi per modellare malattie causate da difetti genetici, incluse le malattie rare per le quali lo sviluppo di nuove terapie può essere particolarmente difficile dato il numero limitato di pazienti (1 su 2000). Le CSPi sono una fonte preziosa di cellule e tessuti, rappresentativa di queste condizioni, presentando le alterazioni genomiche d’interesse e rendendo possibile lo svolgimento di esperimenti in vitro al fine di sviluppare terapie personalizzate innovative.
Con questo lavoro è stato messo a punto un modello in vitro paziente-specifico di CSPi utile per investigare il meccanismo di farmaci potenzialmente efficaci in AT e AGS. Considerando che il numero di studi in questo contesto è ancora limitato, questo lavoro crea le basi per futuri sviluppi relativi alla terapia personalizzata e alle malattie rare con l’obiettivo di estendere lo studio ai tessuti coinvolti nella patogenesi dell’AT e AGS come le cellule del sistema immunitario e del sistema nervoso mediante il differenziamento delle CSPi.