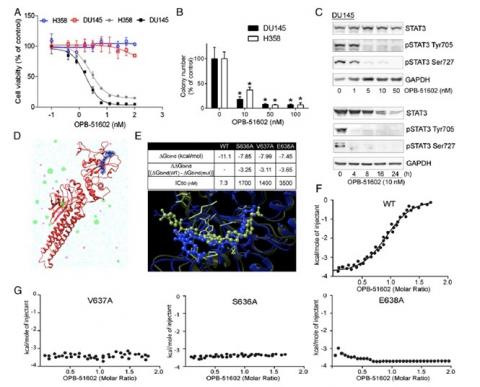
Il fattore di trascrizione STAT3 è una proteina coinvolta in numerosi processi oncogenici e, come tale, costituisce un interessante ma al contempo difficile bersaglio terapeutico in oncologia. Su Proceedings of the National Academy of Science of the United States of America (PNAS), i ricercatori MOSE dell’Università di Trieste dimostrano come un nuovo, potente inibitore di STAT3 interferisca con l’attività mitocondriale e i processi che regolano le proteine all’interno della cellula tumorale, causandone selettivamente la morte.
Le strategie usate dalle cellule tumorali per garantire la loro sopravvivenza varia molto in dipendenza dal tipo di tumore, dal fatto che si tratti di tumore primario o metastatico, e dalla variabilità genetica delle popolazione delle cellule tumorali. Tuttavia, adattare il metabolismo a diverse condizioni fisiologiche è una delle principali capacità che tutte le cellule tumorali hanno per sopravvivere, proliferare e, soprattutto, resistere alle terapie. Quindi, decodificare i processi alla base della riprogrammazione metabolica del tumore può costituire un’arma estremamente efficace dal punto di vista terapeutico sia nell’identificazione di nuovi bersagli molecolari che nella progettazione e lo sviluppo di nuovi percorsi curativi.
I mitocondri sono degli organelli cellulari in grado di svolgere molteplici funzioni tra cui la principale è quella di essere la vera e propria centrale energetica e di riprogrammazione metabolica della cellula. Inoltre, studi molto recenti hanno proposto che i mitocondri giochino un ruolo fondamentale nell’adattamento metabolico e nella resistenza ai farmaci propri delle cellule tumorali. La proteina STAT3 (Signal Transducer and Activator of Transcription 3), in aggiunta al suo ruolo canonico di controllore della velocità di trascrizione delle informazioni genetiche dal DNA all’RNA messaggero, è un fondamentale agente regolatore delle funzioni mitocondriali. Quindi, la possibilità di bloccare le attività di STAT3 attraverso un inibitore selettivo che interferisca in maniera negativa con i meccanismi di sopravvivenza e proliferazione delle cellule tumorali può costituire una efficace ed alternativa strategia terapeutica in campo oncologico.
In questo innovativo settore di ricerca, di natura necessariamente multidisciplinare, due ricercatori MOSE dell’Università degli Studi di Trieste, Sabrina Pricl ed Erik Laurini, hanno appena pubblicato sulla prestigiosa rivista Proceedings of the National Academy of Science of the United States of America (PNAS) i risultati di uno studio internazionale che parte dal computer per arrivare fino in vivo. Tale studio è stato condotto assieme ai colleghi svizzeri (Istituto Oncologico della Svizzera Italiana) e statunitensi (New York University School of Medicine). L’articolo ha avuto come editore il Prof. James E. Darnell, insigne scienziato americano nel campo della biologia cellulare ed autore del testo “Molecular cell biology” adottato in tutti i paesi del mondo come libro riferimento nel settore.
In tale studio, si dimostra per la prima volta come il nuovo farmaco OPB-5602 - prodotto dalla Otsuka Pharmaceuticals (azienda Giapponese che ha contribuito anche al supporto finanziario della ricerca di tutti gli scienziati coinvolti) ed ora già in fase clinica – sia in grado di legarsi con grande affinità a STAT3. L’inibizione dell’attività della proteina provoca a sua volta una complessa serie di eventi a cascata che culminano con un malfunzionamento dei mitocondri e la susseguente morte delle cellule tumorali. Oltre che in vitro, i risultati sono stati riprodotti in vivo, confermando così l’ipotesi alla base dello studio che colpire una cellula tumorale al suo cuore energetico e di riprogrammazione metabolica può costituire un nuovo razionale per lo sviluppo di nuove ed efficaci terapie in campo oncologico.
“I risultati ottenuti nel nostro studio ̶ dichiara il dr. Erik Laurini, primo autore di questo lavoro assieme ai colleghi svizzeri Davide Genini e Lara Brambilla ̶ dimostrano per la prima volta ed in maniera inequivocabile come l’inibizione di STAT3 da parte di OPB-5602 porti a una disfunzione mitocondriale che ha, come conseguenza ultima, un’azione selettiva letale sulle cellule tumorali che basano la loro capacità di sopravvivenza e proliferazione proprio sul funzionamento ottimale della loro centrale energetica e sulla riprogrammazione metabolica a livello mitocondriale.”
“Come ho già avuto modo di affermare in altre occasioni come questa”, aggiunge la Prof.ssa Pricl, “solamente la costituzione di un gruppo di ricerca veramente multidisciplinare, in cui gli scienziati integrano le loro conoscenze di chimica, biofisica, medicina, biologia molecolare, biologia strutturale e computazionale, può portare al traguardo dell’implementazione efficace della ricerca traslazionale attraverso l’identificazione di nuovi approcci terapeutici efficienti. Il nostro gruppo, grazie anche a numerosi finanziamenti nel settore, primo tra tutti quello di AIRC, ci ha permesso di espandere notevolmente la nostra attività in campo sperimentale, spingendo così l’integrazione delle tecniche in silico/in vitro nei campi della biofisica, della biologia strutturale e di quella molecolare ai suoi massimi livelli.”
Informazioni editoriali
www.pnas.org/cgi/doi/10.1073/pnas.1615730114
June 5, 2017
Mitochondrial dysfunction induced by a SH2 domain-targeting STAT3 inhibitor leads to metabolic synthetic lethality in cancer cells
Davide Genini, Lara Brambillaa, Erik Laurini, Jessica Merulla, Gianluca Civenni, Shusil Pandit, Rocco D'Antuono, Laurent Perez, David E. Levy, Sabrina Pricl, Giuseppina M. Carbone, and Carlo V. Catapano
Proceedings of the National Academy of Science of the USA (PNAS), published ahead of print June 5, 2017.
Contatti:
Prof. Sabrina Pricl
MOSE – DEA
Università degli Studi di Trieste
Tel. +39 040 558 3750